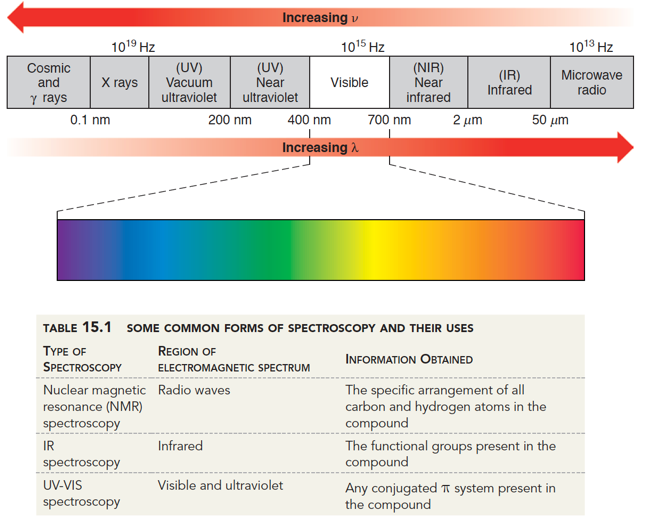
Selain analisis kualitatif menggunakan uji reaksi yang spesifik terhadap gugus-gugus fungsi dalam senyawa organik, metode lain yang dapat digunakan adalah metode spektroskopi. Spektroskopi adalah ilmu yang mempelajari materi dan atributnya berdasarkan cahaya, suara atau partikel yang dipancarkan, diserap atau dipantulkan oleh materi tersebut. Spektroskopi juga dapat didefinisikan sebagai ilmu yang mempelajari interaksi antara cahaya dan materi.
Prinsip Dasar
- Hukum Planck, menjelaskan bahwa suatu energi foton sebanding dengan frekuensi cahaya, berbanding lurus dengan kecepatan cahaya dan berbanding terbalik dengan panjang gelombang cahaya yang dilalukan.
- Hukum Lambert-Beer, menjelaskan bahwa intensitas cahaya yang diserap oleh suatu medium (absorbansi) berbanding lurus dengan konsentrasi dan tebal medium yang menyerap cahaya tersebut. Absorbansi juga merupakan kebalikan dari persen transmitansi (persen cahaya yang diteruskan).
Jenis-Jenis Metode Spektroskopi
- Spektroskopi Ultraviolet
(UV): Keadaan energi elektronik
Digunakan untuk ---- molekul konjugasi, gugus karbonil, gugus nitro
- Spektroskopi Inframerah (IR): keadaan energi vibrasi
Digunakan untuk ---- gugus fungsional, struktur ikatan
- Spektroskopi Resonansi Magnet Inti (NMR): keadaan
spin inti
Digunakan untuk ---- bilangan, tipe dan posisi relatif dari proton (inti hidrogen dan inti karbon-13)
- Spektroskopi Massa (MS): Penembakan elektron berenergi tinggi
Digunakan untuk ---- mengetahui berat molekul, keberadaan nitrogen, halogen
Spektroskopi Ultraviolet (UV)
Radiasi ultraviolet merupakan radiasi elektromagnetik terhadap panjang gelombang yang lebih pendek dari daerah dengan sinar tampak, namun lebih panjang dari sinar-X yang kecil dan dinamai ultraviolet karena frekuensinya lebih tinggi daripada sinar ungu (violet). Radiasi UV dapat dibagi menjadi:- Hampir UV (panjang gelombang : 380-200 nm)
- UV vakum (panjang gelombang : 200-10 nm).
Prinsip kerja spektrofotometer UV-Vis adalah interaksi yang terjadi antara energi yang berupa sinar monokromatis dari sumber sinar dengan materi yang berupa molekul. Besar energy yang diserap tertentu dan menyebabkan elektron tereksitasi dari keadaan dasar ke keadaan tereksitasi yang memiliki energi yang lebih tinggi. Serapan tidak terjadi seketika pada daerah ultraviolet-visible untuk semua struktur elektronik, tetapi hanya pada sistem-sistem terkonjugasi, struktur elektronik dengan adanya ikatan phi dan nonbonding electron.
Auksokrom dengan pasangan elektron bebas ditandai sebagai n memiliki transisinya sendiri, seperti halnya transisi pada ikatan pi aromatik. Bagian molekul yang dapat menjalani transisi elektron tersebut dapat disebut sebagai kromofor sejak transisi tersebut menyerap radiasi elektromagnetik (cahaya). Transisi elektronik molekul yang terjadi diantaranya:
- σ → σ*
- π → π*
- n → σ*
- n → π*
- aromatic π → aromatic π*
- R-band dari bahasa Jerman radikalartig atau radical-like,
- K-band dari bahasa Jerman Konjugierte atau konjugasi,
- B-band dari benzoik
- E-band dari etilenik (sistem disarankan oleh A. Burawoy pada tahun 1930)
 |
| Spektrum UV untuk Molekul Benzena (C6H6) |
Transisi elektron lainnya disajikan pada tabel berikut:
Spektroskopi Inframerah (IR)
Spektrofotometri inframerah lebih banyak digunakan untuk identifikasi suatu senyawa melalui gugus fungsinya. Spektroskopi Inframerah (IR) digunakan untuk menentukan struktur, khususnya senyawa organik dan juga untuk analisis kuantitatif. Bila dibandingkan dengan daerah UV-tampak, di mana energi dalam daerah ini dibutuhkan untuk transisi elektronik , maka radiasi inframerah hanya terbatas pada perubahan energi setingkat molekul. Untuk tingkat molekul, perbedaan dalam keadaan vibrasi dan rotasi digunakan untuk mengabsorbsi sinar infra merah. Jadi untuk dapat mengabsorbsi, molekul harus memiliki perubahan momen dipol sebagai sebagai akibat dari vibrasi. Berarti radiasi medan listrik yang berubah-ubah akan berinteraksi dengan molekul dan akan menyebabkan perubahan amplitudo salah satu gerakan molekul.Daerah radiasi spektroskopi IR berkisar pada bilangan gelombang 12800-10 cm-4, atau panjang gelombang 0,78-1000 µm. umummya daerah radiasi IR terbagi dalam daerah :
- Dekat: 12800-4000 cm-1, 3,8-1,2x1014 Hz, 0,78-2,5 µm
- Tengah: 4000-200 cm-1, 0,012-6x104 Hz, 2,5-50 µm
- Jauh: 200-10 cm-1, 60-3 x 1011 Hz, 50-1000 µm
Saat ini ada dua macam instrumen yaitu spektroskopi IR dan FTIR (Fourier Transformation Infra Red). FTIR lebih sensitif dan akurat seperti dapat membedakan bentuk cis dan trans, ikatan rangkap terkonyugasi dan terisolasi dan lain-lain yang dalam spektrofotometer IR tidak dapat dibedakan.
 |
| Alat Fourier Transform IR (FTIR) |
 |
| Skema Alat Spektrometer Inframerah (IR) |
Selanjutnya juga dapat diketahui daerah-daerah vibrasi dari masing-masing ikatan yang dimiliki oleh senyawa organik dapat dilihat pada tabel dibawah ini.
.pdf+-+SumatraPDF_2012-12-09_00-33-20.png) |
| Spektrum IR dari 2-Butanol |
.pdf+-+SumatraPDF_2012-12-13_22-18-27.png) |
| Spektrum IR dari Benzonitril |
.pdf+-+SumatraPDF_2012-12-09_00-34-04.png) |
| Spektrum IR dari p-metilfenol (p-Cresol) |
Pada bahasan selanjutnya, akan dibahas metode spektroskopi selanjutnya, yaitu NMR (proton dan karbon-13) serta spektrometri massa (MS). Bila ada kekurangan atau pertanyaan, silahkan beri komentar di bawah postingan ini. Terima kasih :D
Daftar Pustaka
- Fessenden, R.J. & Fessenden, J.S., 1999, Kimia Organik, Edisi Ketiga, Penerbit Erlangga, Jakarta
- Hart, H., Leslie, E.C. & David, J.H., 2003, Kimia Organik Suatu Kuliah Singkat, Terjemahan Suminar Setiati Achmadi, Edisi Kesebelas, Penerbit Erlangga, Jakarta
- Pavia, D.L., Lampman, G.M., Kriz, G.S. & Vyvyan, J.R. 2009. Introduction to Spectroscopy. Sauders College. Philadelphia.
- Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Widya Padjadjaran. Bandung.











 Time in Jakarta
Time in Jakarta 
0 comments:
Posting Komentar